Как сокращаются мышцы при тренировке


О том, как устроена мышечная клетка и что представляет из себя мышца, Вы уже имеете понятие. Но, как же осуществляется сокращение мышцы? Что заставляет наши мышцы работать?
Говоря доступным языком, сокращение мышц происходит под воздействием нервных импульсов, которые активируют нервные клетки спинного мозга – мотонейроны, ответвления которых — аксоны подведены к мышце. Если разобраться подробнее, то внутри мышцы аксон разделяется и образует сеть ответвлений, которые, подобно электрическим контактам, «подсоединены» к мышечной клетке. Посредством таких контактов и осуществляется сокращение мышц.

Получается, что каждый мотонейрон управляет группой мышечных клеток. Такие группы получили название – нейромоторные единицы, благодаря которым человек может задействовать в работе часть мышцы. Поэтому, мы можем сознательно контролировать скорость и силу сокращения мышц.
Итак, мы рассмотрели процесс «запуска» сокращения мышц. Теперь давайте детально разберемся, что же происходит непосредственно внутри мышцы во время сокращения. Этот материал несколько сложен для восприятия, но весьма важен. Вам необходимо разобраться в нем, иначе Вы не сможете до конца уяснить, каким образом растут наши мышцы.
Сокращение мышц в грубом приближении
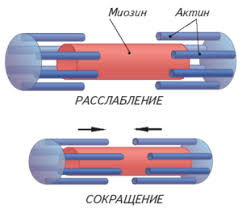
В первую очередь необходимо уяснить, что миофибрилла состоит из многочисленных нитей двух белков: миозина и актина, которые располагаются вдоль миофибриллы. Причем, миозин – толстые нити, а актин – тонкие нити. Этим и объясняется светло-темное полосатое строение миофибриллы (темные полосы – миозин, светлые полосы – актин).
В литературе темные участки миофибриллы получили название А-диск, а светлые участки именуются I-диск. Актиновые нити крепятся к так называемой Z-линии, которая расположена в центре I-диска. Сегмент миофибриллы между Z-линииями, включающий миозиновый А-диск называется саркомером, который можно считать некой сократительной единицей миофибриллы.
Саркомер сокращается следующим образом: при помощи боковых ответвлений (мостиков) толстые нити миозина втягивают вдоль себя тонкие нити актина.

То есть головки мостиков входят в зацепление с актиновой нитью и втягивают ее между нитями миозина. По окончанию движения головки отсоединяются и входят в новое зацепление, продолжая втягивание. Получается, что сокращение мышц – совокупность сокращений множества саркомеров.
Если рассмотреть отдельно тонкую нить актина, то она представляет собой двойную спираль актиновых нитей, между которыми расположена двойная цепь тропомиозина.

Тропомиозин – это также белок, который блокирует зацепления миозиновых мостиков с актином в расслабленном состоянии мышцы. Как только нервный импульс через мотонейрон подается в мышцу, происходит смена полярности заряда мембраны мышечной клетки, в результате чего саркоплазма клетки насыщается ионами кальция (Ca++), которые высвобождаются из специальных хранилищ, находящихся вдоль каждой миофибриллы. Тропомиозиновая нить, в присутствии ионов кальция, мгновенно углубляется между актиновыми нитями, и мостики миозина получают возможность зацепления с актином – сокращение мышц становится возможным.
Однако после поступления Са++ в клетку, он тут же возвращается в свои хранилища и происходит расслабление мышцы. Только при постоянных импульсах, исходящих от нервной системы, мы можем поддерживать длительное сокращение – это состояние получило определение тетаническое сокращение мышц.
Разумеется, сокращение мышц требует энергии. А откуда же она берется, как формируется энергия, поддерживающая движение миозинового мостика? Об этом Вы узнаете в следующей статье Энергетические процессы в мышечной клетке. Энергия сокращения мышц.
© Твой Тренинг
![]()
Материалы данной статьи охраняются законом о защите авторских прав. Копирование без указания ссылки на первоисточник и уведомления автора ЗАПРЕЩЕНО!
Источник
Мы́шечное сокраще́ние — реакция мышечных клеток на воздействие нейромедиатора, реже гормона, проявляющаяся в уменьшении длины клетки. Это жизненно важная функция организма, связанная с оборонительными, дыхательными, пищевыми, половыми, выделительными и другими физиологическими процессами.
Все виды произвольных движений — ходьба, мимика, движения глазных яблок, глотание, дыхание и т. п. осуществляются за счёт скелетных мышц. Непроизвольные движения (кроме сокращения сердца) — перистальтика желудка и кишечника, изменение тонуса кровеносных сосудов, поддержание тонуса мочевого пузыря — обусловлены сокращением гладкой мускулатуры. Работа сердца обеспечивается сокращением сердечной мускулатуры.
Типы[править | править код]
Схема, показывающая мышцы в расслабленном (выше) и сокращённом (ниже) положениях.
Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц). Миофибриллы — структуры толщиной 1-2 мкм, состоящие из саркомеров — структур длиной около 2,5 мкм, состоящих из актиновых и миозиновых (тонких и толстых) филаментов и Z-дисков, соединённых с актиновыми филаментами. Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca2+ в результате скольжения миозиновых филаментов относительно актиновых. Источником энергии сокращения служит АТФ. КПД мышечной клетки около 50 %, мышцы в целом не более 20%. Максимальная сила мышц не достигается в реальных условиях; не все клетки мышцы используются одновременно и сокращаются с максимальной силой, иначе при сокращении многих скелетных мышц будут повреждены сухожилия или кости (что иногда и наблюдается при сильных судорогах). КПД мышцы также зависит от внешних условий; например, на холоде он значительно снижается, так как для организма важнее сохранить температуру тела[1].
Изометрическое сокращение[править | править код]
Основная статья: Изометрическое сокращение[en]
Изометрическое сокращение мышцы создаёт напряжение без изменения длины. Пример можно найти, когда мышцы руки и предплечья захватывают объект; суставы руки не двигаются, но мышцы генерируют достаточную силу, чтобы предотвратить падение объекта.
Изотоническое сокращение[править | править код]
Основная статья: Изотоническое сокращение[en]
При изотоническом сокращении напряжение в мышцах остаётся постоянным, несмотря на изменение длины мышц. Это происходит, когда сила сокращения мышц соответствует общей нагрузке на мышцы.
Концентрическое сокращение[править | править код]
При концентрическом сокращении мышечное напряжение является достаточным для преодоления нагрузки, а мышца укорачивается при сокращении. Это происходит, когда сила, создаваемая мышцей, превышает нагрузку, противодействующую её сокращению.
Эксцентрическое сокращение[править | править код]
См. также: Эксцентрическая тренировка[en]
При эксцентрическом сокращении напряжение недостаточно для преодоления внешней нагрузки на мышцы и мышечные волокна, удлиняются при их сокращении. Вместо того, чтобы тянуть сустав в направлении сокращения мышц, мышца действует так, чтобы замедлить сустав в конце движения или иным образом контролировать перемещение груза. Это может происходить невольно (например, при попытке переместить вес, слишком тяжёлый для подъёма мышцы) или добровольно (например, когда мышца «сглаживает» движение или сопротивляется гравитации, как, например, во время ходьбы вниз). В краткосрочной перспективе силовые тренировки с участием как эксцентрических, так и концентрических сокращений, по-видимому, увеличивают мышечную силу больше, чем тренировки только с концентрическими сокращениями. Однако вызванное физическими упражнениями повреждение мышц также больше при удлинении сокращений.
Эксцентрические сокращения в движении[править | править код]
Эксцентрические сокращения обычно возникают как тормозящее усилие в противоположность концентрическому сжатию, чтобы защитить суставы от повреждения. Во время практически любого обычного движения эксцентрические сокращения помогают сохранять плавность движений, но также могут замедлять быстрые движения, такие как удар или бросок. Часть тренировки для быстрых движений, таких как качки во время бейсбола, включает в себя уменьшение эксцентрического торможения, позволяющего развивать большую мощность во время движения.
Скольжение миозина относительно актина[править | править код]
Головки миозина расщепляют АТФ и за счет высвобождающейся энергии меняют конформацию, скользя по актиновым филаментам.
Цикл можно разделить на 4 стадии:
- Свободная головка миозина связывается с АТФ и гидролизует его до АДФ и фосфата и остаётся связанной с ними. (Обратимый процесс — энергия, выделившаяся в результате гидролиза, запасается в изменённой конформации миозина).
- Головки слабо связываются со следующей субъединицей актина, фосфат отделяется, и это приводит к прочному связыванию головки миозина с актиновым филаментом. Эта реакция уже необратима.
- Головка претерпевает конформационное изменение, производящее подтягивание толстого филамента к Z-диску (или, что эквивалентно, свободных концов тонких филаментов друг к другу).
- Отделяется АДФ, за счёт этого головка отделяется от актинового филамента. Присоединяется новая молекула АТФ.
Далее цикл повторяется до уменьшения концентрации ионов Ca2+ или исчерпании запаса АТФ (в результате смерти клетки). Скорость скольжения миозина по актину ≈15 мкм/сек. В миозиновом филаменте много (около 500) молекул миозина и, следовательно, при сокращении цикл повторяется сотнями головок сразу, что и приводит к быстрому и сильному сокращению. Следует заметить, что миозин ведёт себя как фермент — актин-зависимая АТФаза.
Так как каждое повторение цикла связано с гидролизом АТФ, а следовательно, с положительным изменением свободной энергии, то процесс однонаправленный. Миозин движется по актину только в сторону плюс-конца.
Источник энергии для сокращения[править | править код]
Для сокращения мышцы используется энергия гидролиза АТФ, но мышечная клетка имеет крайне эффективную систему регенерации запаса АТФ, так что в расслабленной и работающей мышце содержание АТФ примерно равно. Фермент фосфокреатинкиназа катализирует реакцию между АДФ и креатинфосфатом, продукты которой — АТФ и креатин. Креатинфосфат содержит больше запасённой энергии, чем АТФ. Благодаря этому механизму при вспышке активности в мышечной клетке падает содержание именно креатинфосфата, а количество универсального источника энергии — АТФ — не изменяется.
Механизмы регенерации запаса АТФ могут различаться в зависимости от парциального давления кислорода в окружающих тканях (см. Анаэробные организмы).
Механизм регуляции[править | править код]
В основном в регуляции мышечной активности участвуют нейроны, но есть случаи, когда сокращением гладкой мускулатуры управляют и гормоны (например, адреналин и окситоцин). Сигнал о сокращении можно разделить на несколько этапов:
От клеточной мембраны до саркоплазматического ретикулума[править | править код]
Воздействие медиатора, выделившегося из мотонейрона, вызывает потенциал действия на клеточной мембране мышечной клетки, который передаётся далее с помощью специальных впячиваний мембраны, называемых Т-трубочками, которые отходят от мембраны внутрь клетки. От Т-трубочек сигнал передаётся саркоплазматическому ретикулуму — особому компартменту из уплощенных мембранных пузырьков (эндоплазматической сети мышечной клетки), окружающих каждую миофибриллу. Этот сигнал вызывает открытие Ca2+-каналов в мембране ретикулума. Обратно ионы Ca2+ попадают в ретикулум с помощью мембранных кальциевых насосов — Ca2+-АТФазы.
От выделения ионов Ca2+ до сокращения миофибрилл[править | править код]
Механизм сокращения мышц с учётом тропонина и тропомиозина
Для того, чтобы контролировать сокращение, к актиновому филаменту прикрепляется белок тропомиозин и комплекс из трёх белков — тропонин (субъединицы этого комплекса называются тропонинами T,I и C). Тропонин C — близкий гомолог другого белка, кальмодулина. Через каждые семь субъединиц актина расположен только один тропониновый комплекс. Связь актина с тропонином I перемещает тропомиозин в положение, мешающее связи миозина с актином. Тропонин C связывается с четырьмя ионами Ca2+ и ослабляет действие тропонина I на актин, и тропомиозин занимает положение, не препятствующее связи актина с миозином.
Источником энергии для сокращения мышечных волокон служит АТФ. При связывании тропонина с ионами кальция активируются каталитические центры для расщепления АТФ на головках миозина. За счет ферментативной активности головок миозина гидролизуется АТФ, расположенный на головке миозина, что обеспечивает энергией изменение конформации головок и скольжение нитей. Освобождающиеся при гидролизе АТФ молекула АДФ и неорганический фосфат используются для последующего ресинтеза АТФ. К миозиновой головке присоединяется новая молекула АТФ. При этом происходит разъединение поперечного мостика с нитью актина. Повторное прикрепление и отсоединение мостиков продолжается до тех пор, пока концентрация кальция внутри миофибрилл не снизится до подпороговой величины. Тогда мышечные волокна начинают расслабляться.
Основные белки миофибрилл[править | править код]
| Белок | Доля белка % | Его мол. масса, kDa | Его функция |
|---|---|---|---|
| Миозин | 44 | 510 | Главный компонент толстых филаментов. Образует связи с актином. Движется по актину за счёт гидролиза АТФ. |
| Актин | 22 | 42 | Главный компонент тонких филаментов. Во время сокращения мышцы по нему движется миозин. |
| Титин | 9 | 2500 | Большой гибкий белок, образующий цепь для связывания миозина с Z-диском. |
| Тропонин | 5 | 78 | Комплекс из трёх белков, регулирующий сокращение при связывании с ионами Ca2+. |
| Тропомиозин | 5 | 64 | Связанный с актиновыми филаментами стержневидный белок, блокирующий движение миозина. |
| Небулин[en] | 3 | 600 | Длинный нерастяжимый белок, связанный с Z-диском и идущий параллельно актиновым филаментам. |
Примечания[править | править код]
Литература[править | править код]
- Б. Альбертс, Д. Брей, Дж. Льюис, М. Рефф, К. Робертс, Дж. Уотсон, Молекулярная биология клетки — В 3-х т. — Пер. с англ. — Т.2. — М.: Мир, 1994. — 540 с.
- М. Б. Беркинблит, С. М. Глаголев, В. А. Фуралев, Общая биология — В 2-х ч. — Ч.1. — М.:МИРОС, 1999. — 224 с.: ил.
См. также[править | править код]
- Миофибриллы
- Саркомер
- Актин
- Миозин
Источник
Рост мышц – это цель каждого бодибилдера. Но мало кто знает, как запустить механизм роста мышц на вашем теле.
На днях решил еще глубже исследовать эту тему. Посмотрел курсы некоторых авторов, перечитал билютень Артура Джонса и обнаружил интересные вещи – они говорят тоже самое что и я, хотя другими словами.

В этой статье я расскажу про физиологию роста мышц и про механизмы стимуляции которые я не указал в прошлой статье. Кстати обязательно ее прочтите, что бы глубже понимать процесс роста мышц и знать как на него повлиять.
Рост мышц. Как заставить мышцы расти. Часть первая
Что бы лучше донести до вас всю информацию, сначала я расскажу о физиологии, а потом расскажу как использовать эти знания для эффективных тренировок и быстрого роста мышц.
Я не медик и не биохимик, поэтому всё буду объяснять простыми словами, практически на пальцах.
Строение мышц

- Аксон
- Нервно-мышечное соединение
- Мышечное волокно
- Миофибриллы
Аксон – это «провод» по которому к мышце поступает электрический сигнал от мозга.
Миофибриллы – это составные части клеток мышечной ткани. Именно они сокращаются и именно они травмируются при силовой нагрузке, превышающей привычную, что вызывает мышечную боль и последующий рост мышц.
Строение сократительной ткани мышц – миофибрилл

Миофибриллы состоят из белков: актина и миозина. У человека толщина миофибрилл составляет 1-2 мкм, а длинна может достигать длинны всей мышцы.
Одна мышечная клетка обычно содержит несколько десятков миофибрилл. На долю миофибрилл приходиться 2/3 всей сухой мышечной массы.

Если еще углубиться в тему, то становиться ясно, что миофибриллы состоят из отдельных отсеков – саркомер.
Как сокращаются мышцы

На рисунке выше вы видите структуру саркомер. Голубым цветом обозначен актин, красным миозин. По краям саркомер есть особый белок к которому крепиться вся конструкция – z-диск. Миозин крепиться к z-диску с помощью белка — титина.
Головка миозина может двигаться под воздействием определенных химических реакций. Она сцепляется с актином и тянет его на себя, тем самым, саркомер уменьшается в длину. Так как саркомеры распологаются последовательно, как вагоны поезда, то их сокращение приводит к уменьшению длинны миофибрилл, и как следствие, мышцы.

Вот структура головки миозина
Вот так происходит «гребок» головки (сокращении мышцы)
На рисунке вы видите как головка миозина тянет на себя актин. Не забываем, что их несколько этажей и тянет не одна головка, а несколько, но каждая в свое время. Читайте дальше.
Единственное топливо для мышц это АТФ
В мышцах человека есть запас АТФ, но его хватает только на 10-12 секунд интенсивной работы, например поднятие штанги или быстрого бега. Дальше организму нужно путем химических реакций добывать АТФ для сокращения мышц из других веществ.
Есть три способа получения АТФ. Вот они (в порядке убывания скорости получение АТФ):
- Расщепление креатинфосфата
- Гликолиз (расщепление гликогена из мышц)
- Окисление
Наверное пока вам непонятно, как наличие АТФ и строение мышц, о котором мы говорили выше, связанно с ростом мышц. Но подождите еще чуть-чуть подошли к самой сути. И вы узнаете какой тренинг поможет вам действительно стимулировать мышцы к росту, а какой должной стимуляции не даст.
Болят мышцы – значит растут!
Как только запас АТФ исчерпан в расход идет креатинфосфат, который быстро восполняет данный пробел. Но креатин тоже не вечный…. Если нагрузка продолжается, то организм начинает расходовать гликоген – запас глюкозы (углеводов) в мышцах). Этот способ значительно медленнее, зато запасов гликогена в мышцах намного больше, чем запасов креатина.
Одна молекула глюкозы расщепляется на две молекулы АТФ. Когда молекула АТФ достигает головки миозина, головка вступает в химическую реакцию и начинает тянуть на себя актин. Смотрите анимацию выше. Но для того, что бы отцепиться от актина и сделать новый гребок, головке нужна еще одна молекула АТФ. И она ее получает. Тогда миозин делает еще один гребок и т.д.
Но есть одна проблема: при получении АТФ из гликогена и креатинфоссфата выделяется кислота, которая мешает поступлению АТФ к миозиновым головкам. Соответственно не все головки успевают отцепится от актина и под действием нагрузки рвутся. Так мы получаем микротравмы и на следующий день испытываем мышечную боль.
Теперь самое интересное: для бодибилдинга самое важное получать от каждого рабочего сета такие микротравмы, потому что это единственный способ заставить мышцы расти. Мы еще подробнее на этом остановимся.
Забыл сказать – первые два способа получения АТФ действуют только при аэробной нагрузке, т.е. при высокой интенсивности тренинга, третий –окисление, используется во время слабых аэробных нагрузках: легкий бег, ходьба, велосипед и т.д. При этом задействуются разные типы мышечных волокон.
Типы мышечных волокон
Есть два типа мышечных волокон: белые (сильные, быстрые) и красные (выносливые, но слабые).
Красные волокна мышц
В отличие от белых этот тип волокон использует окисление для получения АТФ. Окисляется, если я не ошибаюсь гликоген. И получается 38 молекул АТФ, которых хватает на большее время. Но что бы их получить, нужен кислород, поэтому красные мышечные волокна имеют большое кол-во сосудов. Реакция окисления происходит в митохондриях, которых гораздо больше, чем у белых волокон. Митохондрии служат в клетках для получения энергии с помощью кислорода.
Данный способ получения АТФ очень медленный, поэтому красные мышечные волокна не подходят для интенсивной работы, где требуется быстрый выброс АТФ.
В красных волокнах не происходит накопление молочной кислоты! Поэтому они такие выносливые.
В красных волокнах малое кол-во миофибрилл и гликогена, но большое кол-во митохондрий. Гликогена требуется меньше, чем белым волокнам, потому что 1 молекула глюкозы при окислении дает 38 молекул АТФ. Но для передачи этой энергии нужно больше времени, чем при гликолизе.
Белые волокна
Имеют малое кол-во митохондрий, большое кол-во миофибрилл, запасов гликогена и креатинфостфата.
Белым волокнам не нужен кислород для получения энергии (АТФ), поэтому такие нагрузки называются анаэробными, т.е. безкислородными.
Белые волокна вступают в работу только когда требуется приложить большое усилие и работы красных волокон будет недостаточно.
Так как 1 молекула глюкозы в белых волокнах дает всего 2 молекулы АТФ, то гликоген быстро расходуется, но так как не нужен кислород, этот процесс протекает очень быстро. Но есть и обратная сторона: быстрый расход гликогена способствует появлению болшого кол-ва молочной кислоты. Креатин при распаде тоже выделяет кислоту не помню какую.
Но главное, что среда из щелочной становиться кислой это затрудняет доставку АТФ (из-за чего рвутся части миозина) и заставляет нас чувствовать усталость.
Есть еще промежуточный тип мышечного волокна, так называемые розовые волокна, которые могут работать как с кислородом так и без него. Розовые волокна сильнее красных, но менее выносливые, слабее белых но более выносливее.
Зачем я это говорю? Все просто: в нашем теле есть все типы мышечных волокон, у каждого это индивидуально. У разных людей каждая мышца имеет разное кол-во тех или иных волокон. Не бывает так что бы мышца состояла только из белых или только из красных волокон.
Что бы достичь максимальных размеров мышц, за минимально е кол-во времени, нужно задействовать как можно большее кол-во мышечных волокон всех типов. Тогда эффект будет максимальным!
Пост получился длинный и про механизмы стимуляции я расскажу в следующем. А пока подведем итоги.
- Мышца состоит из пучков
- Пучки состоят из клеток
- В каждой мышечной клетке есть миофибриллы – сократительная нить
- Миофибриллы состоят из соркамер, в которых миозин цепляется за актин и начинает его тянуть
- Что бы головка миозина притянулась к актину нужна молекула АТФ
- Что бы головке отцепиться от актина нужна еще одна молекула АТФ
- Работа мышц заставляет их забиваться продуктами распада (кислотами), что ухудшает доступ АТФ к миозину
- Под действием нагрузки, если нет молекулы АТФ, головка, прикрепленная к актину не может отцепитсья и рвется
- Поэтому болят мышцы
- Без таких микротравм мышечный рост невозможен!
- Что бы достичь быстрых результатов нужно развивать все мышечные волокна в теле.
Рост мышц обеспечивают микротравмы мышечного влокна. Какой способ лучше использовать для повышения интенсивности и роста мышц я рассражу в следующей статье. Не пропустите! Это самая важная тема в бодибилдинге!

Источник
